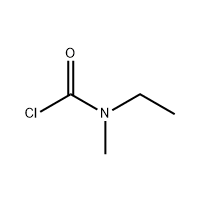
3'-amino-2'-hidroxi-[1,1'-bifenil]-3-karbonsav
3'-amino-2'-hidroxi-[1,1'-bifenil]-3-karbonsav
Az Eltrombopag intermedierjeként 3'-amino-2'-hidroxi-[1,1'-bifenil]-3-karbonsavat használnak.
Az Egyesült Királyságban a GlaxoSmithKline (GSK) által kifejlesztett, majd a svájci Novartis-szal közösen kifejlesztett Eltrombopag az első és egyetlen jóváhagyott kis molekulájú, nem peptid TPO receptor agonista a világon.Az Eltrombopag-ot 2008-ban hagyta jóvá az Egyesült Államok FDA az idiopátiás thrombocytopeniás purpura (ITP), 2014-ben pedig a súlyos aplasztikus anémia (AA) kezelésére.Az elmúlt 30 évben ez az első gyógyszer, amelyet az Egyesült Államok FDA az AA kezelésére jóváhagyott.
2012 decemberében az Egyesült Államok FDA jóváhagyta az Eltrombopag-ot a krónikus hepatitis C-ben (CHC) szenvedő betegek trombocitopéniájának kezelésére, így az alacsony vérlemezkeszám miatt rossz prognózisú hepatitis C-betegek megkezdhetik és fenntarthatják a májbetegségek interferon alapú standard terápiáját.2014. február 3-án a GlaxoSmithKline bejelentette, hogy az FDA megadta az Eltrombopag áttörést jelentő kezelési gyógyszerminősítését a hemopenia kezelésére olyan súlyos Chemicalbook aplasztikus anémiában (SAA) szenvedő betegeknél, akik nem reagáltak teljes mértékben az immunterápiára.2015. augusztus 24-én az Egyesült Államok FDA jóváhagyta az Eltrombopag-ot a thrombocytopenia kezelésére olyan krónikus immunthrombocytopeniában (ITP) szenvedő felnőtteknél és 1 éves és idősebb gyermekeknél, akik nem reagálnak megfelelően kortikoszteroidokra, immunglobulinokra vagy lépeltávolításra.2018. január 4-én az Eltrombopagot jóváhagyták Kínában az elsődleges immunthrombocytopenia (ITP) kezelésére.


![3′-amino-2′-hidroxi-[1,1'-bifenil]-3-karbonsav Kiemelt kép](http://cdn.globalso.com/jindunchem-med/image351.png)
![3'-amino-2'-hidroxi-[1,1'-bifenil]-3-karbonsav](http://cdn.globalso.com/jindunchem-med/image351-300x300.png)
![6-tetra-O-akteil-1-C-[4-klór-3-[[4-[[(3S)-tetrahidrofuran-3-il]-oxi]-fenil]](http://cdn.globalso.com/jindunchem-med/0ecf55f0-300x300.jpg)